最新の研究成果のプレスリリース
・藻類のCO2吸収の鍵となる細胞外タンパク質の機能を解明 -40年来の議論にゲノム編集技術で決着-(2024年)・葉緑体タンパク質が働く場所を変化させ光合成の能力を柔軟に維持する仕組みを発見(2021年)
・光合成により生じたデンプンの新たな機能を発見(2020年)
・藻類のオイル生産を制御する因子を同定 -有用脂質生産の自在制御に向け大きな一歩-(2019年)
・世界初のIntelligent Image-Activated Cell Sorterを開発 -細胞画像の深層学習により高速細胞選抜を実現-(2018年)
・緑藻の体内時計:赤や紫の光情報を体内時計に伝える因子を発見(2017年)
・「光合成のターボエンジン」CO2濃縮機構が葉緑体を介して制御される仕組みを新たに発見(2016年)
・藻類の光合成を支える二酸化炭素濃縮システムを解明(2015年)
モデル緑藻クラミドモナス
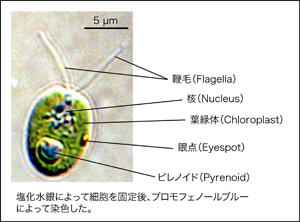
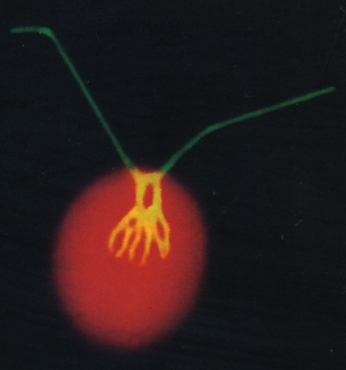
クラミドモナスは最初に葉緑体DNAが発見された生物でもあり、葉緑体・ミトコンドリア・核の3つのゲノムについてDNAの形質転換が可能です。また雌雄株の交配により異なる形質を持つ株を掛けあわせ、 より有用な形質を持つ株を作出する分子育種が可能です。光合成、生殖、鞭毛に関する基礎研究だけでなく、バイオ燃料の生産を目指した応用研究までをカバーする、世界中で注目を浴びているモデル生物です。
我々は最近、迅速かつ高効率のクラミドモナス形質転換系を開発しました(Yamano et al. 2013, 国内及び米国特許取得済)。 この技術により遺伝子破壊株ライブラリーの作成などが格段に容易になり、PCRスクリーニングによって調べたい遺伝子の変異株を単離することが可能となりました。
我々はこれまでにCCMの制御因子(Fukuzawa et al. PNAS 2001, Yoshioka et al. Plant Cell 2004)、無機炭素の輸送に関わるトランスポーター(Yamano et al. PNAS 2015, Ohnishi et al. Plant Cell 2010)、栄養欠乏条件下でTAGの蓄積を正に制御し、窒素欠乏下の光合成活性の抑制に関与する新規な調節因子(Kajikawa et al. Plant Phys. 2015)などを同定してきました。また、cDNA情報を利用したトランスクリプトーム解析の手法を確立し(Miura et al. Plant Phys. 2004)、クラミドモナスの全ゲノム解読を報告しました(Merchant et al. Science 2007)。
さらに、クラミドモナスのゲノムライブラリーや次世代シーケンサーを用いた大規模発現プロファイル情報を整備しており、これらの遺伝子リソースを用いて明らかになった多くの科学的知見が論文として発表されています。クラミドモナスについてさらに詳細な情報を知りたい方は、クラミドモナスのゲノム解読の論文や、下記の日本語の総説記事を参照してください。
-
日本語総説(クリックするとPDFファイルが開きます)
- 福澤秀哉、山野隆志、梶川昌孝
緑藻クラミドモナスにおける無機炭素濃縮機構と脂質代謝 光合成研究 22(3)(2012) - 福澤秀哉、久保雄昭、山野隆志
緑藻クラミドモナスのゲノムから植物と動物の機能を探る 蛋白質核酸酵素 53:1133-1143 (2008) - 福澤秀哉、山野隆志
二酸化炭素による転写調節機構−緑藻クラミドモナスのCO2濃縮機構 蛋白質核酸酵素50:958-965 (2005)
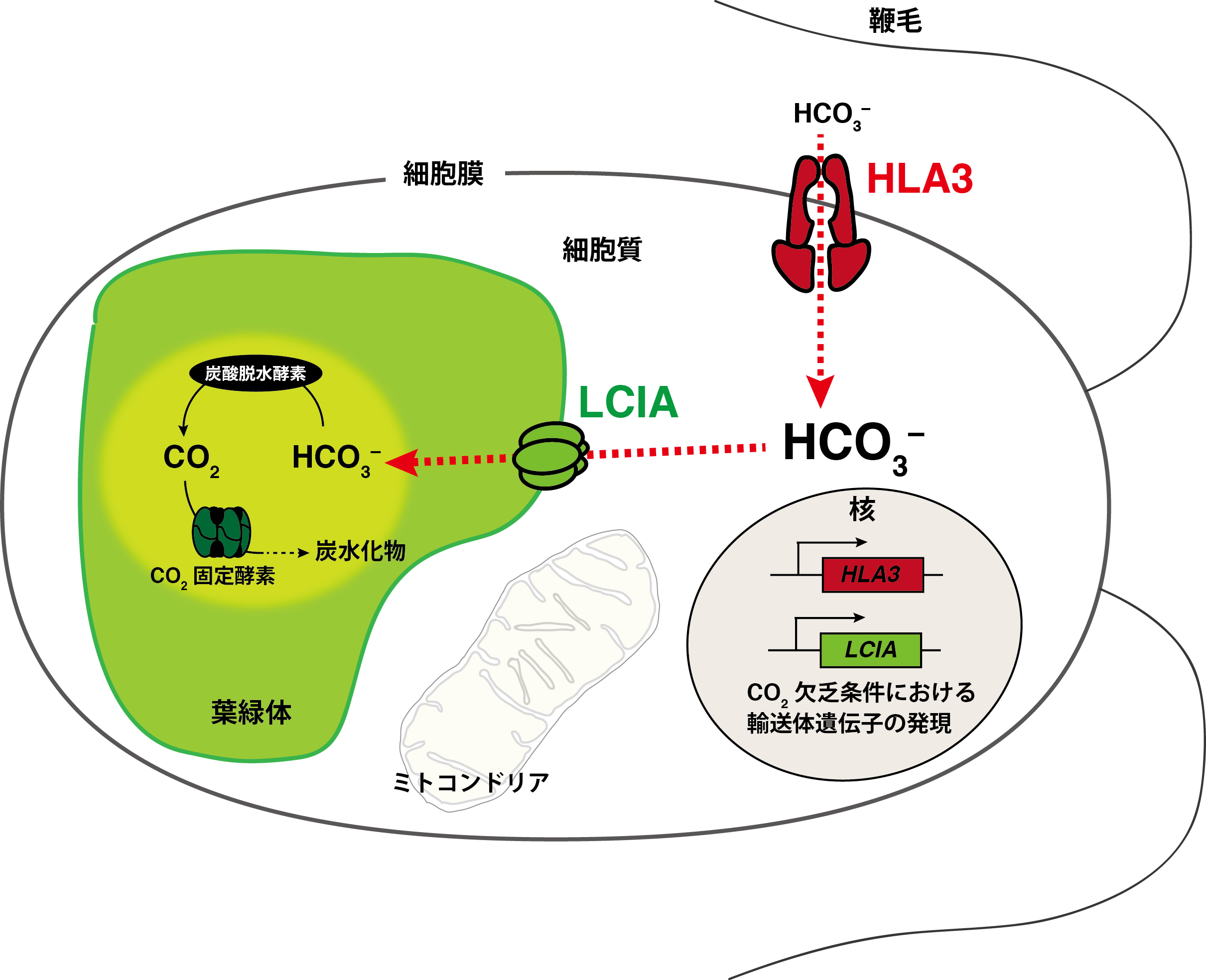
CO2濃縮機構と重炭酸イオン輸送体の発見
水中ではCO2は水と反応して重炭酸イオン(HCO3-)の形で多く存在することが知られています。CO2と異なり、
電荷を帯びた重炭酸イオンは細胞や葉緑体を覆う生体膜を通過することができません。従って、水中の藻類はCO2を細胞内に十分に取り込むことが難しく、
光合成に不利なCO2欠乏環境にさらされます。このような環境においても光合成を維持し生存するために、藻類は細胞膜と葉緑体包膜という2つの障壁を乗り越えて積極的に重炭酸イオンを取り込み、
細胞内に濃縮することで光合成を行うと考えられています。これはシアノバクテリアや藻類が、光エネルギーを用いて細胞外から能動的に無機炭素を細胞内に輸送し、
Rubisco周辺にCO2を濃縮するシステムによることが知られており、CO2濃縮機構(CO2-concentrating mechanism: CCM)と名付けられています。
C4光合成のような維管束鞘細胞と葉肉細胞の複雑な相互作用による有機酸の脱炭酸反応を介する濃縮経路とは異なり、CCMは細胞膜や葉緑体膜に局在する輸送体を介した無機炭素の直接的な輸送によると考えられています。
藻類がこのようなCO2濃縮系(重炭酸イオン輸送系)を持つことは1980年に生理学的に発見されましたが
(Badger et al. Plant Phys. 1980)、その輸送を担っている分子の詳細は長らく不明であり、
藻類の光合成の仕組みを解明するうえで非常に重要な問題として残されていました。
地球の大気に多量に含まれている酸素は、光合成により水が分解されて生じましたが、逆にCO2は光合成によって固定され続けてきました。 光合成によって長い年月蓄えられてきた石炭石油を燃やすことで、大気中のCO2濃度は400 ppmに増加し、現在の地球環境は温暖化・食糧不足・エネルギー枯渇などの様々な問題を抱えています。 これに対して、藻類が持つ遺伝子を利用・改変し、光合成の能力を極限まで高めたスーパー植物を創出することで解決しようとする新たな試みが世界的な競争のなか進められています。 本研究で明らかになった藻類の重炭酸イオン輸送システムをイネやコムギなどの主要作物に導入することでCO2の吸収量と生産量を高め、上記の問題を解決するためのブレイクスルーにつながることが期待されます。
-
関連する論文と総説
- Toyokawa C, Yamano T, Fukuzawa H
Pyrenoid Starch Sheath Is Required for LCIB Localization and the CO2-Concentrating Mechanism in Green Algae. Plant Physiology 182(4):1883-1893 (2020)


- Wang L, Yamano T, Takane T, Niikawa Y, Toyokawa C, Ozawa S, Tokutsu R, Takahashi Y, Minagawa J, Kanesaki Y, Yoshikawa H, Fukuzawa H
Chloroplast-mediated regulation of CO2-concentrating mechanism by Ca2+-binding protein CAS in the green alga Chlamydomonas reinhardtii. Proc. Natl. Acad. Sci. USA 113(44):12586-12591 (2016)




- Yamano T, Sato E, Iguchi H, Fukuda Y, Fukuzawa H
Characterization of cooperative bicarbonate uptake into chloroplast stroma in the green alga Chlamydomonas reinhardtii. Proc. Natl. Acad. Sci. USA 112(23):7315-7320 (2015)




- 山野 隆志、福澤 秀哉
「緑藻クラミドモナスにおける光合成ターボエンジンの駆動と制御」
光合成研究 29(1):14-28 (2019)
藻類の新奇な脂質蓄積制御因子の発見
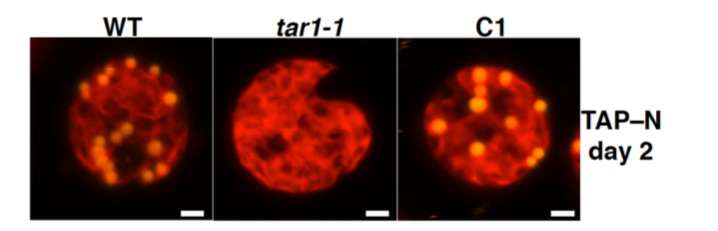
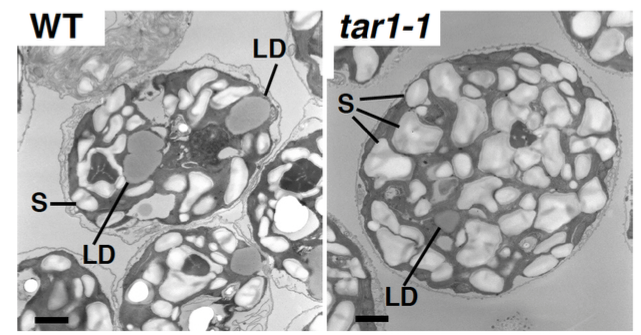
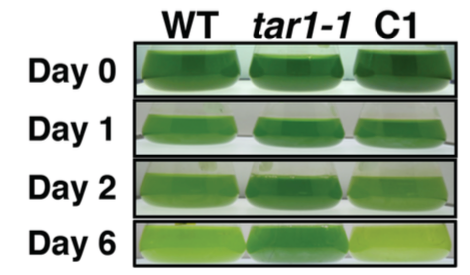
これまでに、脂質の染色蛍光強度を指標として、セルソーター分取システムを用いた変異体のスクリーニングを行い、窒素欠乏状態でトリアシルグリセロール(TAG)の蓄積が異常になる変異体 tag accumulation regulator1 (tar1)を取得しました(Kajikawa et al. Plant Phys. 2015)。変異体tar1 は、酢酸培地を用いた光従属栄養条件で細胞を窒素飢餓状態にすると、野生型に比べて(1) デンプンは蓄積するが TAG 蓄積レベルが10 分の1に低下し、(2) 細胞分裂が停止し細胞サイズが大きくなり、(3) クロロフィルの分解が遅れて光合成の停止が遅れる、という表現型を示しました。これらの結果から、TAR1は窒素飢餓に応答した細胞分裂・光合成・脂質蓄積の制御に係わる事が示唆されました。TAR1遺伝子がコードするタンパク質は、酵母のYak1 と相同性をもつタンパク質リン酸化酵素Dual-Specificity Tyrosine Phosphorylation-Regulated Kinase (DYRK)のサブファミリーの1つでした。さらに、細胞を光独立栄養条件で窒素欠乏にさらすと、クロロフィルを維持したまま、細胞あたりのデンプンに加えてTAGの蓄積量が野生型より増加するという非常に興味深い表現型も観察されています(論文準備中)。また、光独立栄養かつ窒素欠乏条件で野生株とtar1 変異株における遺伝子発現をRNA-seqで網羅的に解析することで、tar1 変異株と野生株との間で発現レベルの差が認められる遺伝子を選び出し、タンパク質リン酸化プロテオーム解析の結果と照らし合わせることで、TAR1が介在するTAGやデンプンの代謝制御系を理解する事を目指しています。
-
関連する論文等
- Kajikawa M, Sawaragi Y, Shinkawa H, Yamano T, Ando A, Kato M, Hirono M, Sato N, Fukuzawa H
Algal dual-specificity tyrosine phosphorylation-regulated kinase, triacylglycerol accumulation regulator1, regulates accumulation of triacylglycerol in nitrogen or sulfur deficiency. Plant Physiol. 168(2):752-64 (2015)
最近の修士・博士論文のタイトル
2022年度
[博士課程]・緑藻のピレノイド局在性因子ならびに核局在性因子による無機炭素濃縮機構の調節
(研究成果が筆頭著者としてPhotosynthesis research誌(2023)に掲載されました。)
[修士課程]
・緑藻におけるCO2濃縮機構の制御: マスター制御因子CCM1及びクロマチンダイナミクスの解析
・緑藻のMYB転写因子LCR1がCO2欠乏条件下で制御する遺伝子の探索とその機能解析
・緑藻のC/Nストレス応答におけるタンパク質リン酸化酵素TAR1とDYRKP1の機能比較
(研究結果の一部がJournal of General and Applied Microbiology 誌に掲載されました。)
2021年度
[修士課程]・緑藻においてC/Nストレス条件下でクロロフィル蓄積量の制御に関わる因子の検討
(研究結果の一部がJournal of General and Applied Microbiology 誌に掲載されました。)
・硫黄欠乏環境でトリアシルグリセロールを高蓄積する緑藻CCDC124変異株の解析
・緑藻におけるCO2濃縮機構を制御する因子CCM1の細胞内局在と機能領域
・緑藻クラミドモナスが持つ液-液相分離するピレノイドの形成異常株の単離と解析
・緑藻においてCO2濃縮機構を制御するタンパク質CBP1の局在と機能
2020年度
[修士課程]・緑藻のC/Nストレス応答における2つのDYRK型キナーゼの関連性と新奇制御因子
(研究結果の一部がJournal of General and Applied Microbiology 誌に掲載されました。)
・緑藻における重炭酸イオンチャネルLCIAの発現調節変異株の解析
・Regulation of LCIA in Chlamydomonas reinhardtii and low sodium-dependency of photosynthesis in the diatom Chaetoceros gracilis
(研究結果の一部がMarine Biotechnology誌(2021)に掲載されました。)
2019年度
[博士課程]・緑藻のCO2濃縮機構におけるピレノイドデンプン鞘の役割
(研究成果が筆頭著者としてPlant Physiology誌(2020)に、また共著者としてPlant Physiology誌(2022)に掲載されました。)
・炭素と窒素の栄養バランス応答における緑藻のタンパク質リン酸化酵素TAR1の機能
(研究成果が筆頭著者としてPlant&Cell Physiology誌(2019)に掲載されました。)
[修士課程]
・緑藻のピレノイド形成に関わるSAGA1タンパク質のCO2濃縮機構における役割
(研究成果の一部がPhotosynthesis research誌(2023)に掲載されました。)
・C/Nストレス条件でトリアシルグリセロールを高蓄積する緑藻のCCDC124変異株の解析
2018年度
[修士課程]・緑藻における無機炭素濃縮機構必須因子LCIBの局在制御
(研究成果の一部がPlant Physiology誌(2022)に掲載されました。)
・緑藻のC/Nストレス応答異常変異株pp2c3の解析
・珪藻における無機炭素濃縮機構関連因子の探索と重炭酸イオン輸送体SLC4-1の解析(修士課程)
(研究成果の一部がMarine Biotechnology誌(2021)に掲載されました。)
・珪藻の脂質代謝改変によるリシノール酸生産能の改良
2016年度
[博士課程]・A calcium-binding protein CAS regulates the CO2-concentrating mechanism in the green alga Chlamydomonas reinhardtii
(研究成果が筆頭著者としてPNAS誌(2016)に掲載されました。)
[修士課程]
・珪藻Chaetoceros gracilisにおけるリシノール酸の生産
(研究成果の一部がScientific Reports誌(2016)に掲載されました。)
・CO2濃縮機構を制御するCCM1複合体およびCASの解析
(研究成果の一部がPNAS誌(2016)に掲載されました。)
・緑藻クラミドモナスと珪藻ツノケイソウにおける重炭酸イオン輸送体の解析
(研究成果の一部がPNAS誌(2015)に掲載されました。)
・クラミドモナス窒素欠乏応答変異株およびシロイヌナズナAtYak1変異株の解析
2015年度
[修士課程]・トリアシルグリセロール蓄積異常株tar1の単離と解析
(研究成果の一部がPlant Physiology誌(2015)に掲載されました。)
・無機炭素濃縮能を制御する新規因子CrCASの機能解析
(研究成果の一部がPNAS誌(2016)に掲載されました。)
2014年度
[修士課程]・緑藻クラミドモナスにおけるスクアレン代謝の制御機構の解析
(研究成果の一部がPLOS ONE誌(2015)に掲載されました。)
・緑藻クラミドモナスにおける低CO2誘導性膜タンパク質LCIAとHLA3の機能解析
(研究成果の一部がPNAS誌(2015)に掲載されました。)
・緑藻クラミドモナス野生株C9のSNPs解析および珪藻キートセロスのCO2欠乏条件下における光合成特性
・緑藻クラミドモナスにおけるCO2応答に異常を持つ変異株の単離およびオートファジー関連遺伝子の機能解析
2013年度
[修士課程]・光とCO2に依存して局在変化する葉緑体タンパク質LCIBの機能解析
(研究成果の一部がPhotosynthesis Research誌(2014)に掲載されました。)
・ユニークな糖結合モジュールを含むビフィズス菌のα-galactosidaseはB型血液型抗原に特異的に作用する
(研究成果が筆頭著者としてGlycobiology誌に掲載されました。)
・Bifidobacterium longum subsp.longum JCM1217由来GH43グリコシダーゼの解析
・線虫Caenorhabditis elegansへのグルコサミン投与による寿命への影響の解析
・ビフィズス菌Bifidobacterium longum subsp. longum JCM 1217由来GH31酵素の解析
・緑藻クラミドモナスにおけるオレイン酸代謝の改変ならびにオートファジーの機能解析








