2026年
![]() Shimamura D, Yasuda J, Yamahara Y, Nakano H, Ozawa S, Tokutsu R, Yamagami A, Matsushita T, Takahashi Y, Nakano T, Fukuzawa H, Yamano T*
Shimamura D, Yasuda J, Yamahara Y, Nakano H, Ozawa S, Tokutsu R, Yamagami A, Matsushita T, Takahashi Y, Nakano T, Fukuzawa H, Yamano T*
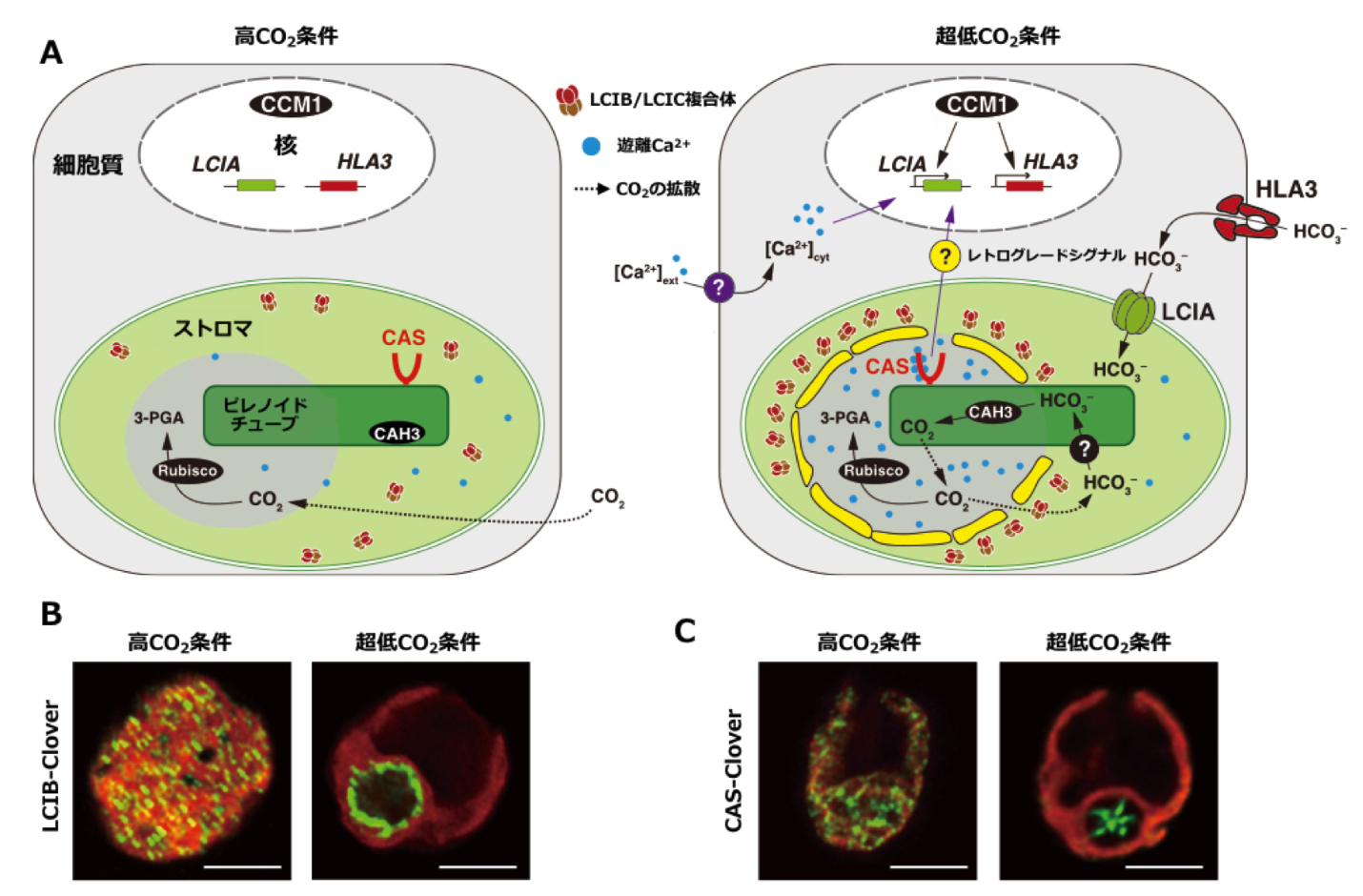
A nuclear CobW/WW-domain factor represses the CO2-concentrating mechanism in the green alga Chlamydomonas reinhardtii.
bioRxiv doi: 10.1101/2025.07.09.663896
Proc Natl Acad Sci USA.2026 Feb 10;123(6):e2518136123.



【解説】藻類の光合成において、長年の謎だったCO2濃縮機構(CCM)の核内抑制因子を発見しました。CCMは多大なエネルギーを消費するため、その停止機構の解明は細胞の「省エネ」の鍵でした。我々は、CCMの“アクセル”である活性化因子CCM1/CIA5に直接結合し、その働きを抑える新規の抑制タンパク質CBP1を同定しました。
2025年
研究開発の俯瞰報告書「植物ものづくり」
JST 研究開発戦略センター(CRDS)

Japan can be a science heavyweight once more — if it rethinks funding
Nature 2025 Feb;638(8050):318-320. doi: 10.1038/d41586-025-00394-8.


【解説】日本の科学技術政策の問題点を指摘し、解決策を提示したオピニオン記事です。東大の合田教授が主導し、3名のノーベル賞受賞者を含む日本人研究者138名の連名発表です。
CRISPR遺伝子編集や人工知能による蛋白質構造予測など、現代の重要な科学的成果は学際的研究から生まれています。しかし日本では、研究資金が個別の専門分野に限定され、分野横断的な研究支援が不足しています。その結果、世界の高被引用論文における日本のシェアは過去20年で6%から2%に低下しています。
この状況を改善するため、記事では研究者中心の支援、ハイリスク研究の推進、審査の多様化、基盤的資金の充実、複数年度にわたる柔軟な資金提供を提言します。その成功例として、水平的な組織構造と分野横断的な協働で成果を上げているOISTが挙げられます。
日本には、より大胆な研究支援モデルと活力ある研究文化を育む潜在力があり、その実現は日本の科学技術と経済の発展に不可欠だと考えます。
オピニオンに関する朝日新聞の記事
![]() Yamano T*
Yamano T*
Algal Pyrenoids in Global Carbon Cycling: Frontier Research on Structure, Function, and Convergent Evolution
Algal Science and Technology 18(1):13-25

【解説】地球規模の炭素循環の約3分の1を担う藻類のCO2濃縮装置「ピレノイド」について、その分子基盤と進化的意義を包括的に解説した総説です。近年解明が進む、液-液相分離によるマトリックスの形成原理や、CO2の漏出を防ぐ拡散バリア、および効率的な基質供給を担う膜構造など、ピレノイドを構成する精緻な分子メカニズムを詳述しています 。また、緑藻や珪藻といった異なる系統が、いかにして物理化学的に類似したCO2濃縮機構を獲得したかという「収斂進化」の視点や、環境変動に応答した多層的な制御系についても論じています 。さらに、これらの基礎的知見を応用して陸上作物の光合成効率を向上させる試みや、バイオテクノロジー分野への貢献など、将来的な工学的展望についても触れています。
Yamaoka Y*, Petroutsos D, Je S, Yamano T, Li-Beisson Y
Light, CO2, and carbon storage in microalgae
Curr Opin Plant Biol. 2025 Feb 20:84:102696. doi: 10.1016/j.pbi.2025.102696.


【解説】本論文では、微細藻類における光とCO2の相互作用が炭素代謝に与える影響について解説しています。光が光合成のエネルギー源としてだけでなく、光受容体を介した調節シグナルとして機能し、青色光と赤色光が脂質やデンプン生合成に異なる影響を与えることを示しました。また、葉緑体内のATPとNADPHのバランスが炭素の分配先を決定し、CO2濃縮機構が光合成効率を高める仕組みについても解説しています。さらに、細胞小器官間のエネルギー交換が全体の代謝調節に重要な役割を果たしていることを明らかにしました。これらの知見は、微細藻類を活用したバイオテクノロジーの発展に貢献するものと考えています。

嶋村 大亮、松田 晏実、山野 隆志*
「細胞外炭酸脱水酵素による緑藻のCO2取り込み促進」
バイオサイエンスとインダストリー(B&I) 2025 83(2):1320133
2024年
![]() Shimamura D, Ikeuchi T, Matsuda A, Tsuji Y, Fukuzawa H, K Mochida, Yamano T*
Shimamura D, Ikeuchi T, Matsuda A, Tsuji Y, Fukuzawa H, K Mochida, Yamano T*
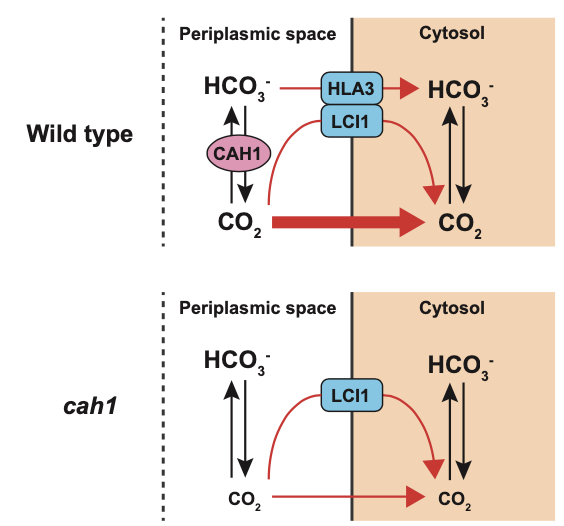
Periplasmic carbonic anhydrase CAH1 contributes to high inorganic carbon affinity in Chlamydomonas reinhardtii
Plant Physiol. 2024 Dec 2;196(4):2395-2404. doi: 10.1093/plphys/kiae463.



【解説】藻類は地球環境を維持する上で重要な役割を果たしていますが、そのCO2吸収のメカニズムには未解明な部分が多くありました。今回の研究では、炭酸脱水酵素(CAH1)と呼ばれる酵素に着目し、緑藻の一種であるクラミドモナスを用いて実験を行いました。遺伝子操作によってCAH1を持たない藻類を作り出したところ、特にCO2が少ない環境下で炭素吸収効率が大幅に低下することが分かりました。一方、CAH1を再導入するとCO2吸収能力が回復したことから、CAH1の重要性が明らかになりました。本研究は、その発見から40年以上続いてきた水圏光合成におけるCAH1の役割についての議論に決着をつけるものであり、藻類の生態学的な重要性を再認識させるものです。将来的には、この知見を活用することで環境問題解決に向けた新たな戦略が生まれる可能性があります。
松尾 光治良、山野 隆志*
「水圏光合成の駆動と制御に関わるCO2濃縮オルガネラの分子基盤」
月刊アグリバイオ 2024年7月臨時増刊号
山野 隆志*
「緑藻のピレノイドとCO2濃縮機構」
『微細藻類で取り組むバイオ生産の現状と将来』月刊アグリバイオ 2024年2月号
2023年
山野 隆志*
「シアノバクテリアのCO2濃縮機構」
『独立栄養細菌によるCO2資源化技術』 第Ⅱ編第18章 pp.227-232 シーエムシー出版 2023年12月13日 発行
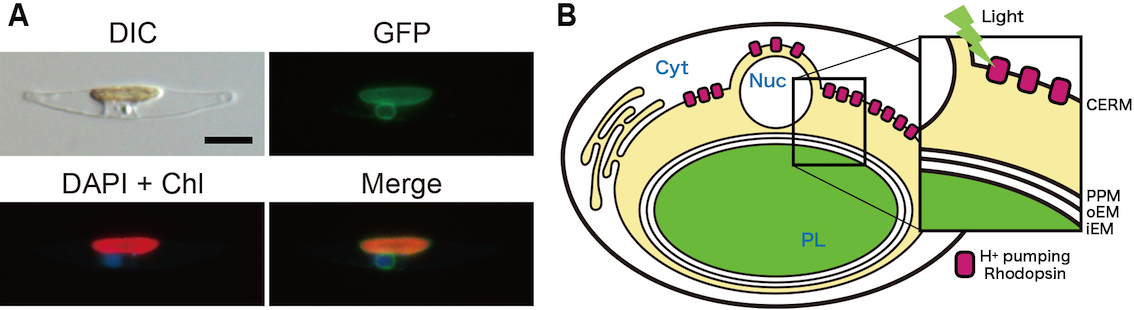
 Yoshizawa S*, Azuma T, Kojima K, Inomura K, Hasegawa M, Nishimura Y, Kikuchi M, Armin G, Tsukamoto Y, Miyashita H, Ifuku K, Yamano T, Marchetti A, Fukuzawa H, Sudo Y, Kamikawa R
Yoshizawa S*, Azuma T, Kojima K, Inomura K, Hasegawa M, Nishimura Y, Kikuchi M, Armin G, Tsukamoto Y, Miyashita H, Ifuku K, Yamano T, Marchetti A, Fukuzawa H, Sudo Y, Kamikawa R
Light-driven proton pumps as a potential regulator for carbon fixation in marine diatoms
Microbes Environ. 2023;38(2):ME23015. doi: 10.1264/jsme2.ME23015.


東大吉澤研との共同研究成果です。
光駆動型H+輸送(微生物型ロドプシン)で生じる局所的酸性プールがCO2固定を促進する理論モデルを提唱しました。
2023年 M&E論文賞を受賞しました!
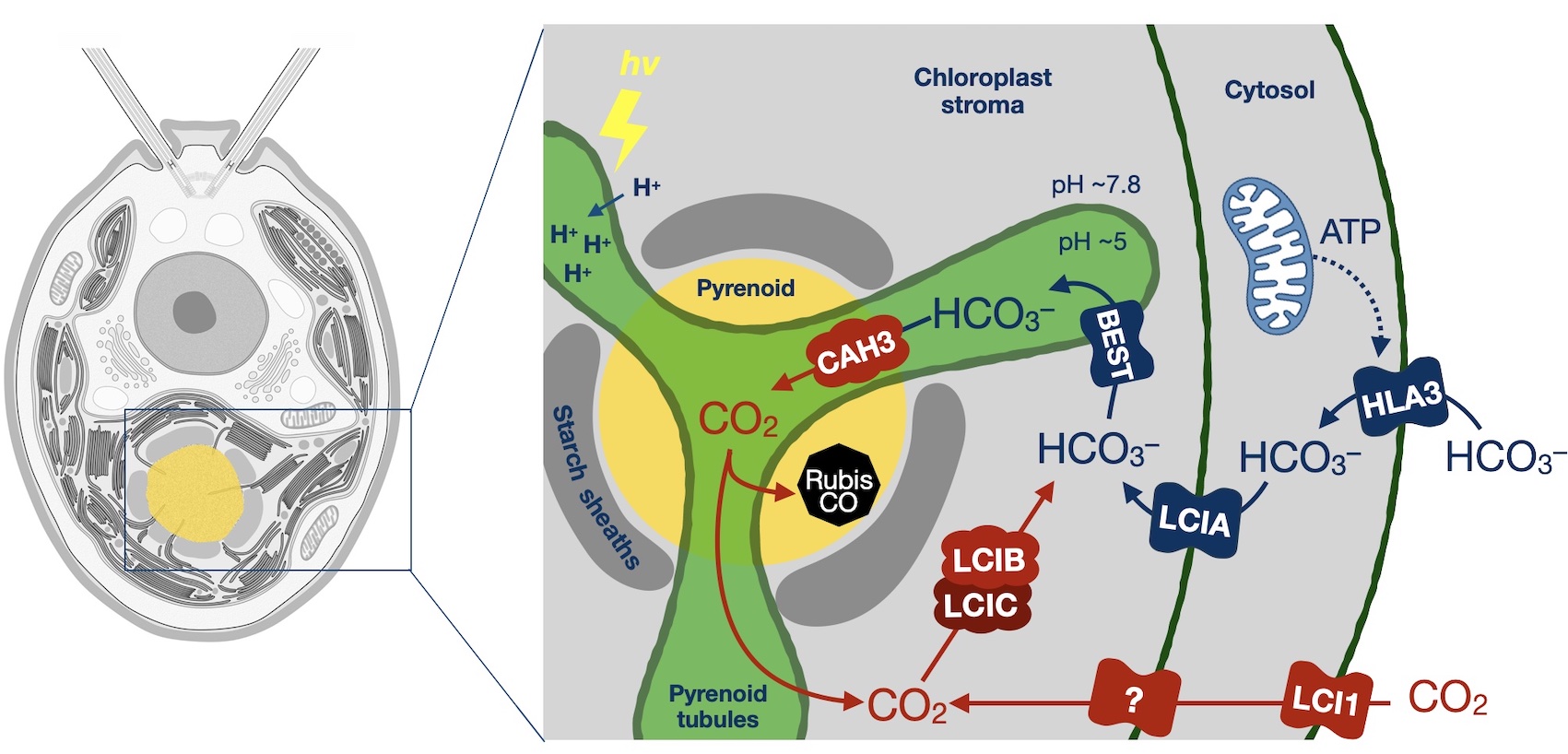
山野 隆志*
「相分離するCO2濃縮オルガネラとしての緑藻ピレノイドの理解」
Plant Morphology 35: 3-8 (2023)

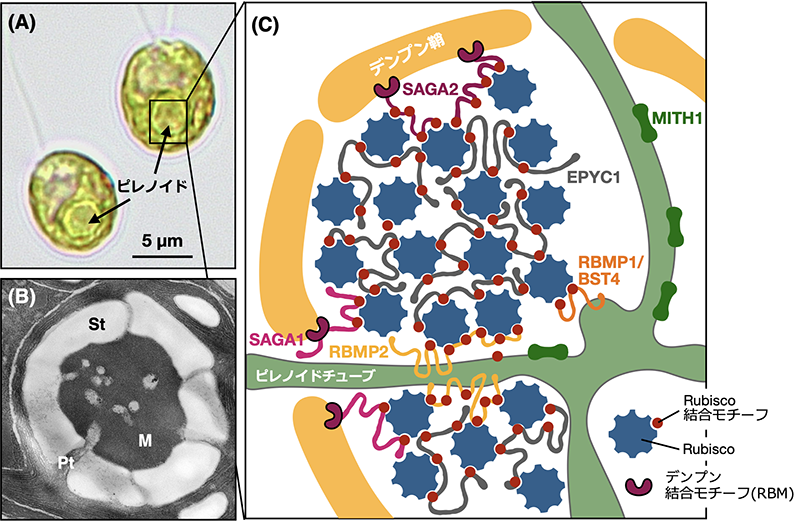
【解説】モデル緑藻クラミドモナスを用いた研究により、ピレノイド形成の分子メカニズムの理解が大きく進みました。本総説では,ピレノイドの機能的な構成要素であるピレノイドマトリックス、デンプン鞘とその周辺タンパク質、ピレノイドチューブの構造が,CO2をRubisco周囲に濃縮する目的を達成するために、藻類が系統を超えて収斂進化により獲得した普遍的な構造であるという視座を提供するとともに、ピレノイド構造とCO2濃縮機構の構造-機能相関について、筆者の成果を含めた最新の研究例を紹介しています。
山野 隆志*、平川 泰久、松﨑 令
「ピレノイド:植物の相分離オルガネラのカッティング・エッジ」
Plant Morphology 35: 1-2 (2023)

【解説】ピレノイドは、葉緑体内でCO2固定酵素RubisCOが集積することで形作られ、水圏における効率的なCO2固定反応において中心的な役割を担う。ピレノイド研究の歴史は古く、主に形態分類学の分野を中心に行われてきた。しかし近年、緑藻クラミドモナスのピレノイドが液-液相分離する性質の発見や、その相分離に必要な分子の発見など、エポックメイキングな研究が相次ぎ、ピレノイド形成の分子メカニズムに関する研究が大きく進展している。このような背景を受け、日本植物学会第86回大会では、日本植物形態学会との共催のもとで、「ピレノイド:植物の相分離オルガネラのカッティング・エッジ」と題したシンポジウムを開催した。
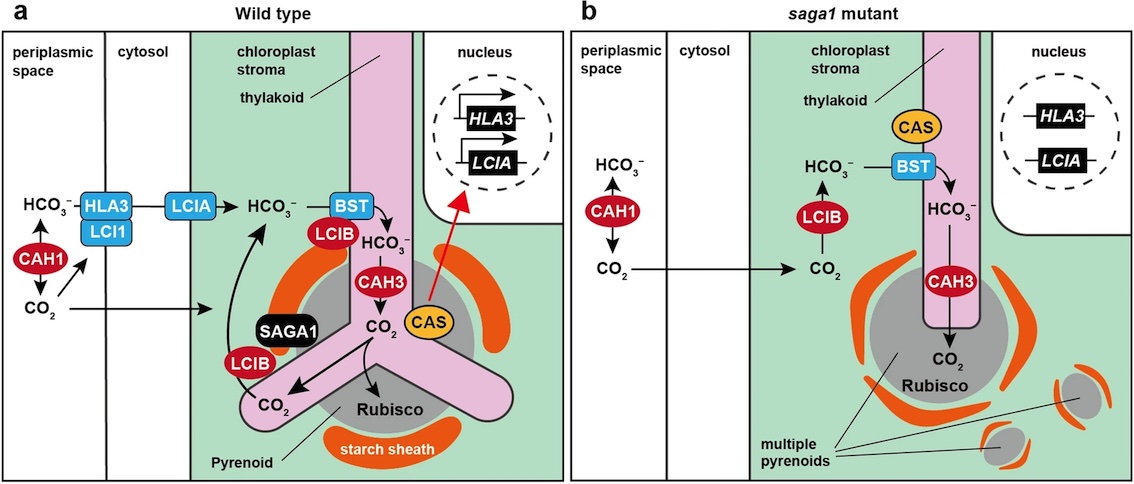
Shimamura D, Yamano T*, Niikawa Y, Donghui H, Fukuzawa H
A pyrenoid-localized protein SAGA1 is necessary for Ca2+-binding protein CAS-dependent expression of nuclear genes encoding inorganic carbon transporters in Chlamydomonas reinhardtii
Photosynth Res. 2023 May;156(2):181-192. doi: 10.1007/s11120-022-00996-7.


【解説】非膜オルガネラ「ピレノイド」の形成に必須な因子SAGA1が欠損すると、Wang et al. 2016で同定したカルシウム結合タンパク質CASの葉緑体内局在変化や、核における重炭酸イオン輸送体の遺伝子発現が損なわれることを明らかにしました。ピレノイドは光合成におけるCO2固定の「駆動」だけでなく、核内遺伝子発現の調節を介したCO2濃縮機構の「制御」においても重要であるという、ピレノイドの機能の新たな側面を見出しました。ピレノイドが葉緑体から核へのレトログレードシグナルの発信源であるという仮説をもとに、さらなる研究を進めています。
2022年
![]() Gururaj M, Ohmura A, Ozawa M, Yamano T, Fukuzawa H, Matsuo T*
Gururaj M, Ohmura A, Ozawa M, Yamano T, Fukuzawa H, Matsuo T*
A potential EARLY FLOWERING 3 homolog in Chlamydomonas is involved in the red/violet and blue light signaling pathways for the degradation of RHYTHM OF CHLOROPLAST 15
PLoS Genet. 2022 Oct 17;18(10):e1010449. doi: 10.1371/journal.pgen.1010449.


名大 松尾研(現・北里大)との共同研究成果です。
Tsuji Y*, Kinoshita A, Tsukahara M, Ishikawa T, Shinkawa H, Yamano T, Fukuzawa H*
A YAK1-type protein kinase, triacylglycerol accumulation regulator 1, in the green alga Chlamydomonas reinhardtii is a potential regulator of cell division and differentiation into gametes during photoautotrophic nitrogen deficiency
J Gen Appl Microbiol. 2023 Jun 22;69(1):1-10. doi: 10.2323/jgam.2022.08.001.


【解説】DYRK型タンパク質リン酸化酵素の1つTAG accumulation regulator 1 (TAR1) の欠損変異体を複数の野生株からゲノム編集により作出して、その機能の見直しを進めました。 そして、CO2のみを炭素源とする光独立栄養条件かつ窒素欠乏条件において、TAR1欠損変異体は細胞分裂が阻害されることから、「細胞分裂を制御することで分化を促進する」というDYRKの広く知られた機能が緑藻でも保存されていることを示しました。 また、当研究室で最適化したCRISPR-Cas9を用いたゲノム編集技術についても詳細に記載しています。
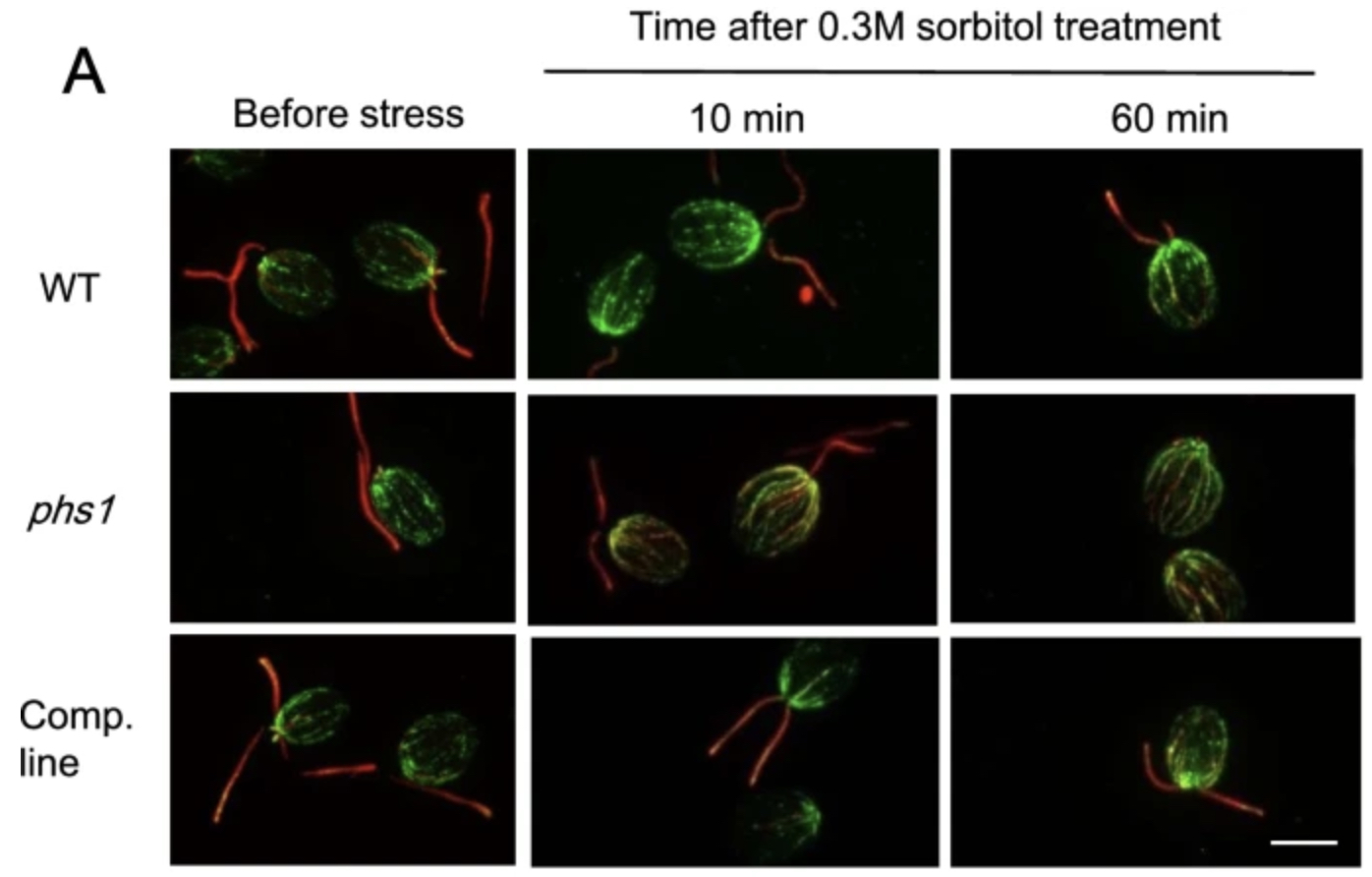
![]() Mei NL, Komaki S, Takahashi H, Yamano T, Fukuzawa H, Hashimoto T*
Mei NL, Komaki S, Takahashi H, Yamano T, Fukuzawa H, Hashimoto T*
Hyperosmotic stress-induced microtubule disassembly in Chlamydomonas reinhardtii
BMC Plant Biol. 2022 Jan 22;22(1):46. doi: 10.1186/s12870-022-03439-6.


奈良先端大 橋本研究室との共同研究成果です。
クラミドモナスを用いて高浸透圧ストレスによる細胞骨格の応答を調べ、PROPYZAMIDE-HYPERSENSITEVE 1 (PHS1)が、G1期と分裂期の両方で細胞内の大部分のα-チューブリンを速やかにリン酸化し、これが微小管の一時的な分解を引き起こすことを明らかにしました。PHS1遺伝子は陸上植物と緑藻に共通しており、これらの生物における微小管のストレス応答機構が類似している可能性が示唆されました。
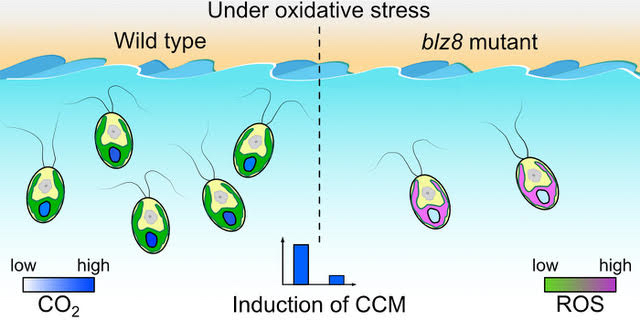
Choi BY, Kim H, Shim D, Jang S, Yamaoka Y, Shin S, Yamano T, Kajikawa M, Jin E, Fukuzawa H*, Lee Y*
The Chlamydomonas bZIP transcription factor BLZ8 confers oxidative stress tolerance by inducing the carbon-concentrating mechanism
Plant Cell 2022 Feb 3;34(2):910-926. doi: 10.1093/plcell/koab293.


韓国POSTECH Lee研究室との共同研究成果です。
クラミドモナスがもつbZIP転写因子の1つがCCMの駆動に関わる無機炭素輸送体や炭酸脱水酵素の発現を制御し、酸化ストレスに対して耐性を付与することを明らかにしました。
紹介記事
Microalgae concentrate CO2 to ameliorate oxidative stress
The Plant Cell: In a Nutshell
![]() Yamano T*, Toyokawa C, Shimamura D, Matsuoka T, Fukuzawa H
Yamano T*, Toyokawa C, Shimamura D, Matsuoka T, Fukuzawa H
CO2-dependent migration and relocation of LCIB, a pyrenoid-peripheral protein in Chlamydomonas reinhardtii
Plant Physiol. 2022 Feb 4;188(2):1081-1094. doi: 10.1093/plphys/kiab528.



LCIBの局在変化には、LCIBと結合するタンパク質LCICが必要であること、またその局在変化には光や光合成は必要なくCO2濃度が7 µMを境として切り替わることを発見しました。
CO2の濃度が変動する不均一な環境下で、藻類が葉緑体タンパク質の局在を細やかに変化させることで、光合成の能力を柔軟に維持する仕組みの一端を明らかにしました。
日経産業新聞で紹介されました。
藻類に光合成の能力保つ仕組み 京大解明

2022年1月19日 日経産業新聞
2021年
Tsuji Y, Kusi-Appiah G, Kozai N, Fukuda Y, Yamano T, Fukuzawa H*
Characterization of a CO2-Concentrating Mechanism with Low Sodium Dependency in the Centric Diatom Chaetoceros gracilis.
Mar Biotechnol (NY). 2021 Jun;23(3):456-462. doi: 10.1007/s10126-021-10037-4.


海産珪藻は熱帯雨林に匹敵する生産力を持ち、その高い生産性はCO2濃縮機構(CCM)により支えられています。モデル珪藻Phaeodactylumを用いたこれまでの研究では、海水中のナトリウム塩がCCMの駆動に必要であることが報告されていました。これに対し本研究では、実用珪藻として知られるツノケイソウ(Chaetoceros gracilis)のCCMはナトリウム塩への依存度が低く、ナトリウム塩を含まない培地中でもCCMが駆動することを示しました。本研究で明らかになった珪藻種間におけるナトリウム塩依存度の違いは、塩濃度が異なる様々な環境(外洋〜河口域)での珪藻の繁栄をもたらした要因の一つと推測されます。
2020年
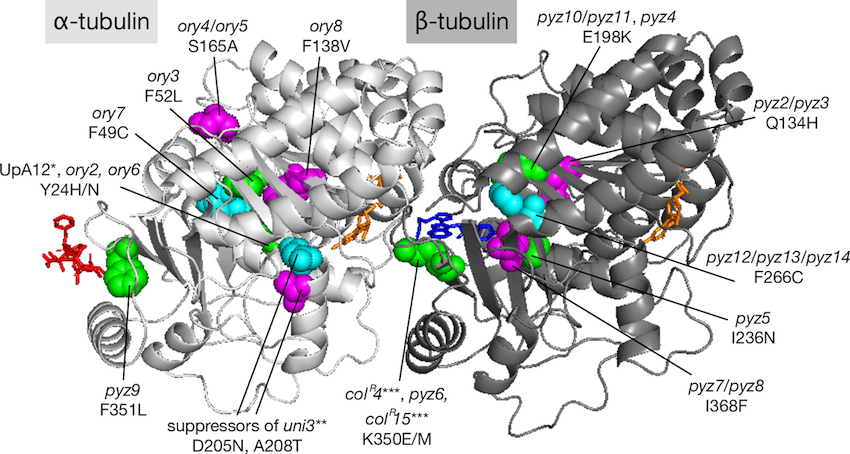
Chlamydomonas reinhardtii tubulin-gene disruptants for efficient isolation of strains bearing tubulin mutations.
PLoS One. 2020 Nov 23;15(11):e0242694. doi: 10.1371/journal.pone.0242694.


中央大学 箕浦研究室との共同研究成果です。
モデル緑藻クラミドモナスは、鞭毛をもつためチューブリン研究に広く使われています。一方、クラミドモナスはα-tubulin遺伝子とβ-tubulin遺伝子をそれぞれ2コピーずつ持つため、単一のチューブリン遺伝子に変異が生じてももう1つの遺伝子の機能的な相補により明確な表現型をもつ変異株を取得するのが困難でした。本論文では、まずそれぞれのチューブリン遺伝子の挿入変異株を単離し、それを親株として、抗tubulin薬剤であるpropyzamideやoryzalinに対して抵抗性を示す変異株を20株単離することに成功しました。これらの変異株リソースは、チューブリンの構造と機能の関係を研究する上で有用であると考えられます。
山野 隆志
「ピレノイド:光合成におけるCO2濃縮装置」
「相分離生物学の全貌」白木賢太郎 編 東京化学同人
「はじめに」から抜粋。
光合成におけるCO2濃縮装置「ピレノイド」が注目を集めている。それは、1803年に発見されたピレノイドが、約200年の時を経て、相分離するオルガネラとして「再発見」されたからだけではなく、ピレノイドを陸上植物へ導入し光合成を改良させる試みが、食糧問題解決の糸口になる可能性を秘めているからでもある。ピレノイドは、地球上の光合成における炭酸固定の約3割を担い、生物相の一次生産を根幹から支えているが、その形成や分裂に関わる機構の大部分が謎に包まれている。近年、真核緑藻クラミドモナスをモデルとした研究により、ピレノイドの構造と性質の理解に大きな進展が見られた。本稿では、主にクラミドモナスのピレノイドの構造的な特徴と相分離する性質がその機能とどのように結びついているのかを紹介し、ピレノイド研究の方向性の鍵となる未解決の疑問を提供したい。

![]() Nitta N, Iino T, Isozaki A, Yamagishi M, Kitahama Y, Sakuma S, Suzuki Y, Tezuka H, Oikawa M, Arai F, Asai T, Deng D, Fukuzawa H, Hase M, Hasunuma T, Hayakawa T, Hiraki K, Hiramatsu K, Hoshino Y, Inaba M, Inoue Y, Ito T, Kajikawa M, Karakawa H, Kasai Y, Kato Y, Kobayashi H, Lei C, Matsusaka S, Mikami H, Nakagawa A, Numata K, Ota T, Sekiya T, Shiba K, Shirasaki Y, Suzuki N, Tanaka S, Ueno S, Watarai H, Yamano T, Yazawa M, Yonamine Y, Di Carlo D, Hosokawa Y, Uemura S, Sugimura T, Ozeki Y, Goda K*
Nitta N, Iino T, Isozaki A, Yamagishi M, Kitahama Y, Sakuma S, Suzuki Y, Tezuka H, Oikawa M, Arai F, Asai T, Deng D, Fukuzawa H, Hase M, Hasunuma T, Hayakawa T, Hiraki K, Hiramatsu K, Hoshino Y, Inaba M, Inoue Y, Ito T, Kajikawa M, Karakawa H, Kasai Y, Kato Y, Kobayashi H, Lei C, Matsusaka S, Mikami H, Nakagawa A, Numata K, Ota T, Sekiya T, Shiba K, Shirasaki Y, Suzuki N, Tanaka S, Ueno S, Watarai H, Yamano T, Yazawa M, Yonamine Y, Di Carlo D, Hosokawa Y, Uemura S, Sugimura T, Ozeki Y, Goda K*
Raman image-activated cell sorting
Nat Commun. 2020 Jul 10;11(1):3452. doi: 10.1038/s41467-020-17285-3.


東大 合田研究室との共同研究成果です。
![]() Toyokawa C, Yamano T, Fukuzawa H*
Toyokawa C, Yamano T, Fukuzawa H*
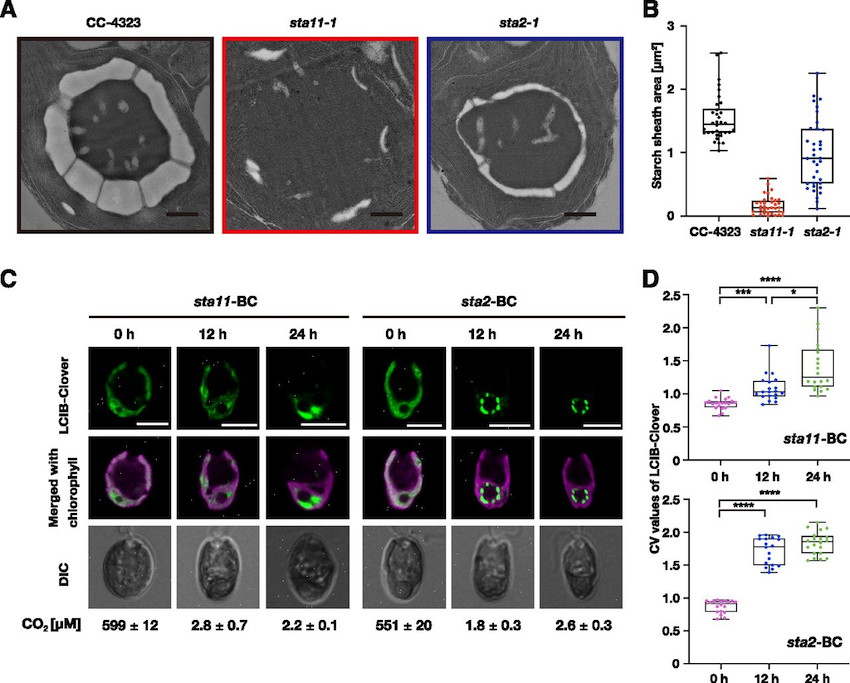
Pyrenoid Starch Sheath Is Required for LCIB Localization and the CO2-Concentrating Mechanism in Green Algae.
Plant Physiol. 2020 Apr;182(4):1883-1893. doi: 10.1104/pp.19.01587.



藻類のピレノイドは約200年も前に見いだされた葉緑体内の構造で、近年では液-液相分離する非膜オルガネラとしても注目を集めています。ピレノイドの周りにはデンプン鞘と呼ばれる構造が形成されることが知られていましたが、その役割については不明でした。本論文は分子遺伝学・細胞生物学的な手法によって、緑藻クラミドモナスのデンプン鞘がCO2濃縮機構の必須因子LCIBのピレノイド周囲への局在や、CO2濃縮機構の維持に重要であることを示し、貯蔵物質としてのデンプンの新たな役割について明らかにしました。同誌の注目論文をピックアップするNews and Viewsでも紹介されました。
紹介記事
Mukherjee A
CO2 Concentration in Chlamydomonas reinhardtii: Effect of the Pyrenoid Starch Sheath.
Plant Physiol. 2020 Apr;182(4):1796-1797. doi: 10.1104/pp.20.00267.


Yamano T, Fukuzawa H*
Transformation of the Model Microalga Chlamydomonas reinhardtii Without Cell-Wall Removal.
Methods Mol Biol. 2020;2050:155-161. doi: 10.1007/978-1-4939-9740-4_16.



NEPA21を用いた迅速かつ高効率なクラミドモナス形質転換のプロトコル。
![]() Jang S, Kong F, Lee J, Choi BY, Wang P, Gao P, Yamano T, Fukuzawa H, Kang BH, Lee Y*
Jang S, Kong F, Lee J, Choi BY, Wang P, Gao P, Yamano T, Fukuzawa H, Kang BH, Lee Y*
CrABCA2 Facilitates Triacylglycerol Accumulation in Chlamydomonas reinhardtii under Nitrogen Starvation.
Mol Cells. 2020 Jan 31;43(1):48-57. doi: 10.14348/molcells.2019.0262.


韓国POSTECH Lee研究室との共同研究成果です。
2019年
LIPID REMODELING REGULATOR 1 (LRL1) Is Differently Involved in the Phosphorus-depletion Response from PSR1 in Chlamydomonas reinhardtii.
Plant J. 2019 Nov;100(3):610-626. doi: 10.1111/tpj.14473.



東工大 太田研究室との共同研究成果です。
藻類はリンや窒素などの栄養欠乏時に細胞内にオイルを多量に蓄積することが広く知られています。この仕組みの解明が、藻類で様々な有用脂質を自在に生産するための大きな手掛かりになると考えられていました。
今回、種々の藻類で広く見られる栄養欠乏時のオイルの大量蓄積を制御する制御因子を我々の変異株ライブラリを用いて発見しました。明らかになった脂質蓄積の制御の機構や制御因子自体を、藻類で生産する有用脂質の種類や生産の時期を自在にコントロールするための仕組みづくりに活用することが期待されます。
Isozaki A, Mikami H, Hiramatsu K, Sakuma S, Kasai Y, Iino T, Yamano T, Yasumoto A, Oguchi Y, Suzuki N, Shirasaki Y, Endo T, Ito T, Hiraki K, Yamada M, Matsusaka S, Hayakawa T, Fukuzawa H, Yatomi Y, Arai F, Di Carlo D, Nakagawa A, Hoshino Y, Hosokawa Y, Uemura S, Sugimura T, Ozeki Y, Nitta N, Goda K*
A practical guide to intelligent image-activated cell sorting.
Nature Protoc. 2019 Aug;14(8):2370-2415. doi: 10.1038/s41596-019-0183-1.


東大 合田研究室との共同研究成果です。
2018年にCell誌で報告した「インテリジェント画像活性型細胞選抜法」の詳細なプロトコルです。表紙に採用されました。

山野 隆志、福澤 秀哉*
「緑藻クラミドモナスにおける光合成ターボエンジンの駆動と制御」
光合成研究 29(1):14-28 (2019)

緑藻クラミドモナスのCCMの総説。多くの藻類は、CO2欠乏ストレス環境においても光合成を維持するために、膜輸送体やチャネルを用いて積極的に細胞外から葉緑体に無機炭素を取り込み、固定酵素周辺にCO2を濃縮する仕組み「無機炭素濃縮機構(CCM)」を持ちます。 「光合成のターボエンジン」にも例えられるこの仕組みは、シアノバクテリア、緑藻、珪藻を用いた研究でその共通性と多様性が明らかになってきました。本総説では、無機炭素濃縮機構の駆動とその制御について、クラミドモナスを中心に最新の知見を紹介しています。
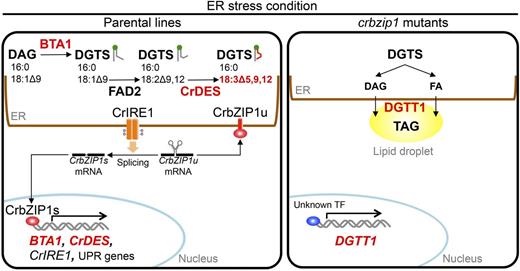
![]() Yamaoka Y, Shin S, Choi BY, Kim H, Jang S, Kajikawa M, Yamano T, Kong F, Legeret B, Fukuzawa H, Li-Beisson Y, Lee Y*
Yamaoka Y, Shin S, Choi BY, Kim H, Jang S, Kajikawa M, Yamano T, Kong F, Legeret B, Fukuzawa H, Li-Beisson Y, Lee Y*
The bZIP1 Transcription Factor Regulates Lipid Remodeling and Contributes to ER Stress Management in Chlamydomonas reinhardtii.
Plant Cell May;31(5):1127-1140. doi: 10.1105/tpc.18.00723.


韓国POSTECH Lee研究室との共同研究成果です。
脂質蓄積制御に関わる新奇な因子を同定しました。
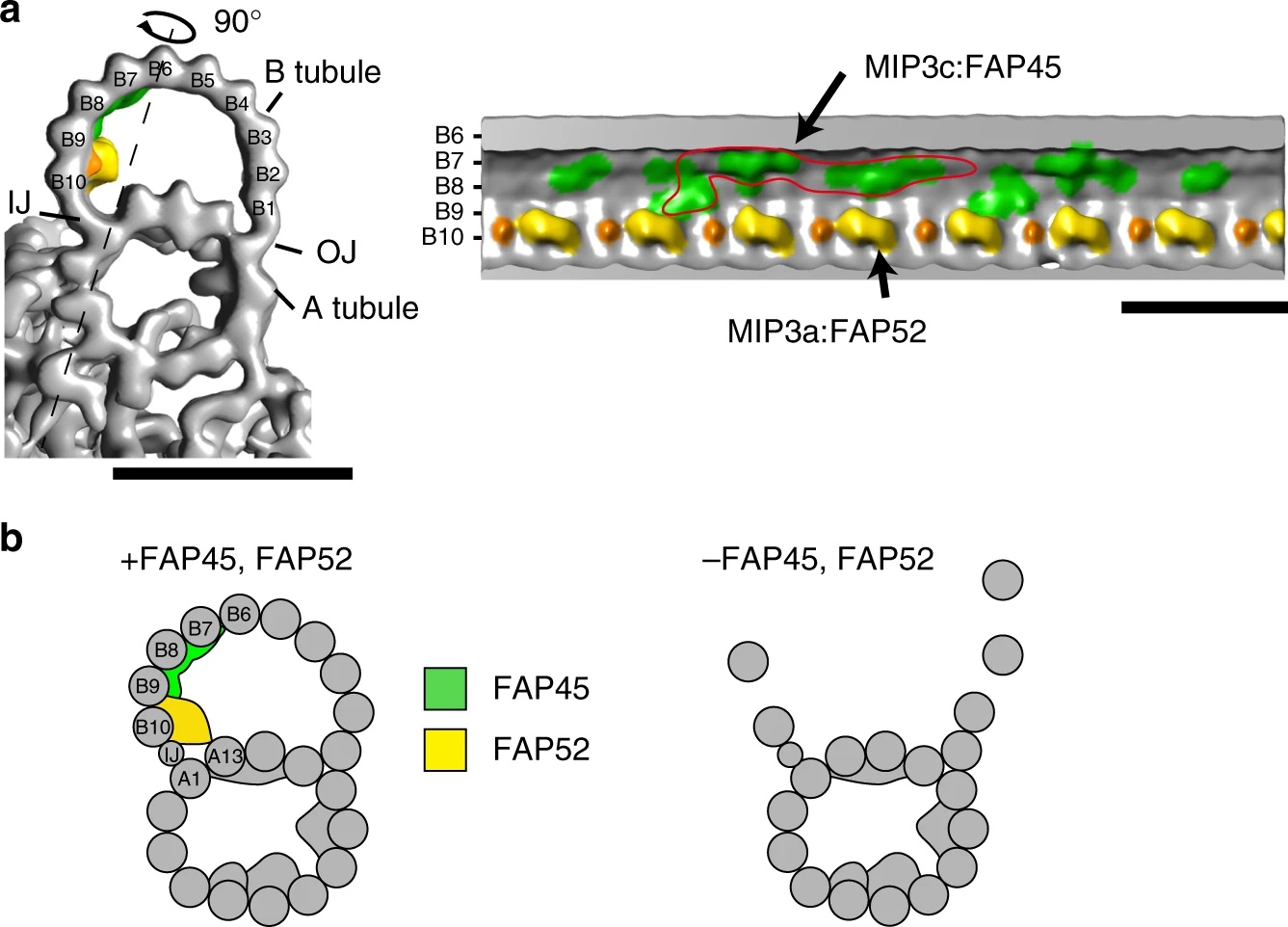
![]() Owa M, Uchihashi T, Yanagisawa H, Yamano T, Iguchi H, Fukuzawa H, Wakabayashi K, Ando T, Kikkawa M*
Owa M, Uchihashi T, Yanagisawa H, Yamano T, Iguchi H, Fukuzawa H, Wakabayashi K, Ando T, Kikkawa M*
Inner lumen proteins stabilize doublet microtubules in cilia and flagella.
Nature Commun. 2019 Mar 8;10(1):1143. doi: 10.1038/s41467-019-09051-x.



東大 吉川研究室との共同研究成果です。
繊毛・鞭毛の微小管内側に結合し、その構造を補強する新奇タンパク質について報告しました。
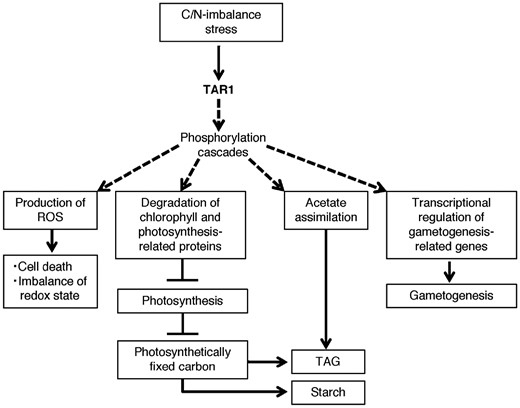
![]() Shinkawa H, Kajikawa M, Nomura Y, Ogura M, Sawaragi Y, Yamano T, Nakagami H, Sugiyama N, Ishihama Y, Kanesaki Y, Yoshikawa H, Fukuzawa H*
Shinkawa H, Kajikawa M, Nomura Y, Ogura M, Sawaragi Y, Yamano T, Nakagami H, Sugiyama N, Ishihama Y, Kanesaki Y, Yoshikawa H, Fukuzawa H*
Algal Protein Kinase, Triacylglycerol Accumulation Regulator1, Modulates Cell Viability and Gametogenesis in Carbon/Nitrogen Imbalanced Conditions.
Plant Cell Physiol. 2019 Apr 1;60(4):916-930. doi: 10.1093/pcp/pcz010.



DYRK型タンパク質リン酸化酵素TAR1は、栄養欠乏下での緑藻の脂質蓄積、クロロフィルと光合成関連タンパク質の分解の制御因子として2015年に私達が報告しました。今回、TAR1が活性酸素種の発生や接合に必要であることがわかってきました。またリン酸化プロテオーム解析によりTAR1のリン酸標的タンパク質の候補因子として複数のタンパク質リン酸化酵素や窒素同化および炭素代謝に関わる酵素タンパク質を見出しました。
2018年
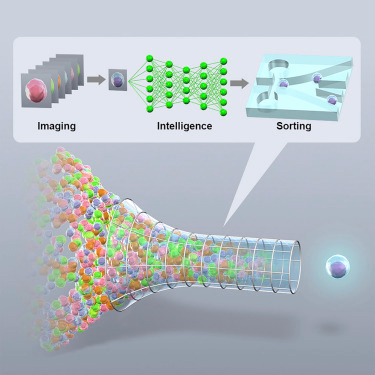
Intelligent Image-Activated Cell Sorting
Cell 2018 Sep 20;175(1):266-276.e13. doi: 10.1016/j.cell.2018.08.028.




東大、JST、理研他との共同研究成果です。
今回開発された技術「Intelligent Image-Activated Cell Sorter」により、従来は手作業でおこなっていた希少細胞(変異株)の選抜時間が約6,500倍に短縮され、偶然の幸運な発見(Serendipity)が可能になることを実証しました。私たちは、環境中のCO2濃度を検知して葉緑体内部で移動するタンパク質を可視化し、その局在が異常になった変異株の単離に成功しました。今後は、得られた変異株を調べる事で、光合成炭素固定を支えるCO2濃縮機構の制御や葉緑体内部でのタンパク質移行のメカニズムの解明が期待されます。
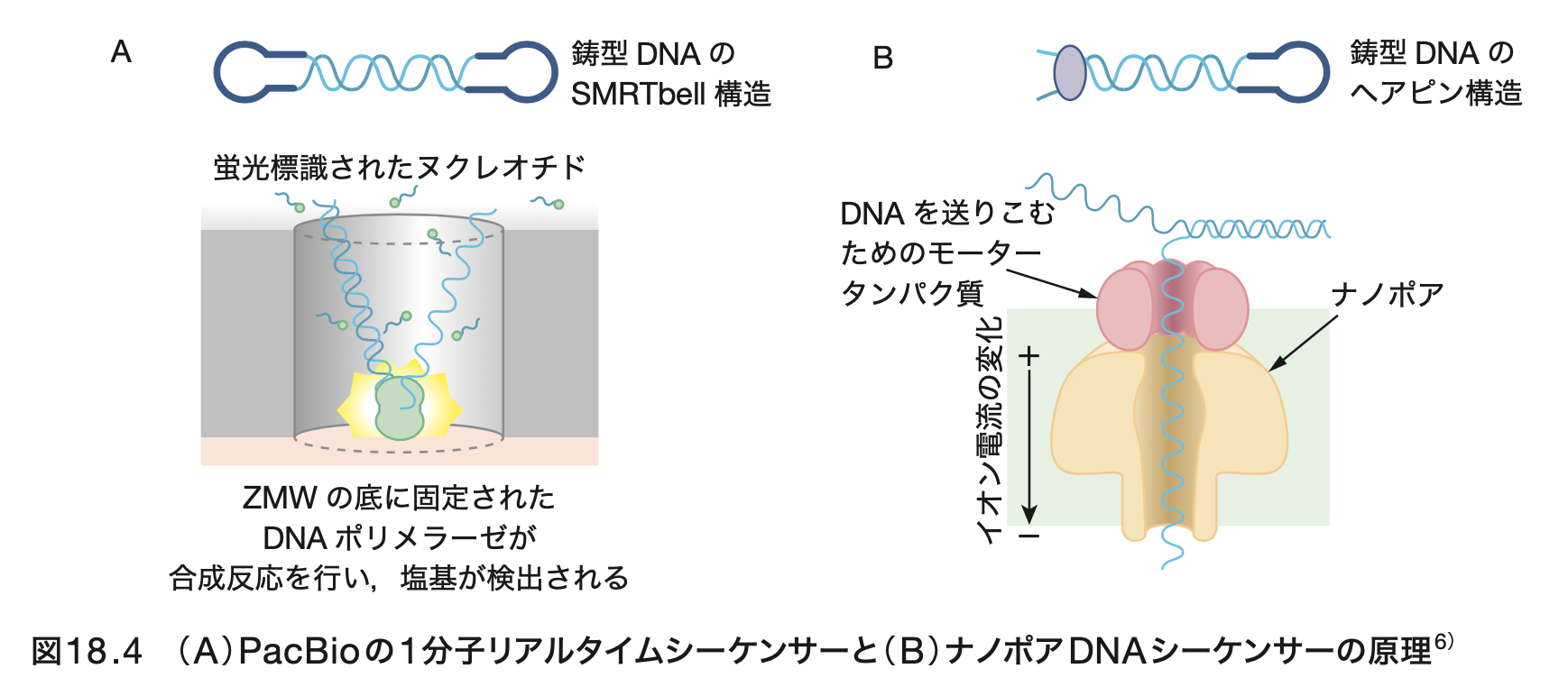
山野 隆志 18章「体の設計図を読む ゲノム情報と進化」
「京大発!フロンティア生命科学」京都大学大学院生命科学研究科 編 講談社
「はじめに」から一部抜粋。
現代の生物学の発展はさまざまな技術によって支えられてきた。その中でも、「核酸の配列をどのようにして読むか」という極めてシンプルな問題に対する技術革新は、次世代シーケンシング(Next Generation Sequencing; NGS)の登場とともに爆発的な勢いで進歩しており、生命科学の常識をあっという間に変えてしまった。サンガー法により行われたヒトゲノム計画は、30億ドルの金をつぎこんだ世界規模のプロジェクトだった。その後、アメリカによる1,000ドルゲノム計画への舵取りと、ムーアの法則を上回るNGSの技術革新によってそのコストは何万倍にも低下し、ありとあらゆる生物のゲノム情報が個人でも手の届く時代が到来した。本章では、多くの研究者が奮闘したDNA配列決定とヒトゲノム解読の歴史を簡単にふり返り、現在爆発的に発展している次世代シークエンシング技術の一部とゲノム解析がもたらした科学的知見について紹介したい。
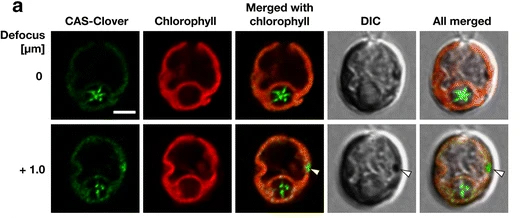
Yamano T, Toyokawa C, Fukuzawa H*
High-resolution suborganellar localization of Ca2+-binding protein CAS, a novel regulator of CO2-concentrating mechanism.
Protoplasma. 2018 Jul;255(4):1015-1022. doi: 10.1007/s00709-018-1208-2.



Wang et al. 2016 PNASで報告したCa2+結合タンパク質CASの細胞内局在を高解像度イメージング技術で明らかにしました。高CO2条件では葉緑体全体に拡散しているCASが、 CO2濃縮機構が誘導されるCO2欠乏条件ではピレノイドへと局在を変化させる様子を捉えました。同誌のEditorialでも紹介されました。
紹介記事
Nick P
Phase in space
Protoplasma 255(4):987-988 (2018)


2017年
![]() Kinoshita A, Niwa Y, Onai K, Yamano T, Fukuzawa H, Ishiura M, Matsuo T*
Kinoshita A, Niwa Y, Onai K, Yamano T, Fukuzawa H, Ishiura M, Matsuo T*
CSL encodes a leucine-rich-repeat protein implicated in red/violet light signaling to the circadian clock in Chlamydomonas.
PLOS Genet. 2017 Mar 23;13(3):e1006645. doi: 10.1371/journal.pgen.1006645.




名大 松尾研(現・北里大)との共同研究成果です。
科学新聞で紹介されました。
緑藻で赤や紫の光情報を体内時計に伝える因子発見

2016年
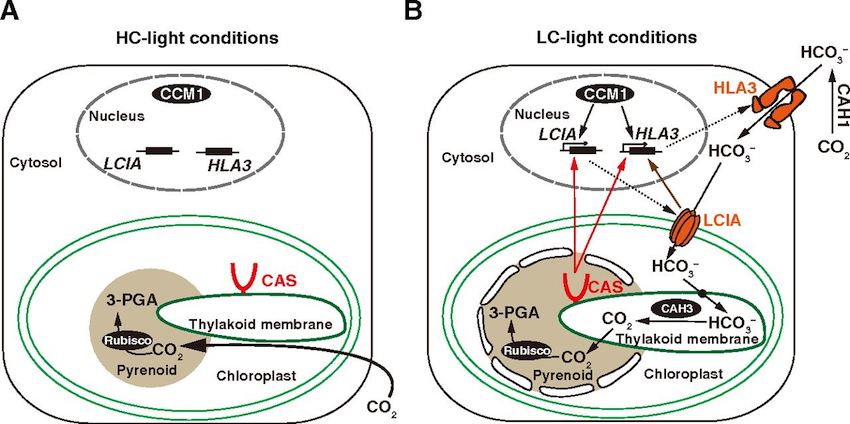
![]() Wang L, Yamano T, Takane T, Niikawa Y, Toyokawa C, Ozawa S, Tokutsu R, Takahashi Y, Minagawa J, Kanesaki Y, Yoshikawa H, Fukuzawa H*
Wang L, Yamano T, Takane T, Niikawa Y, Toyokawa C, Ozawa S, Tokutsu R, Takahashi Y, Minagawa J, Kanesaki Y, Yoshikawa H, Fukuzawa H*
Chloroplast-mediated regulation of CO2-concentrating mechanism by Ca2+-binding protein CAS in the green alga Chlamydomonas reinhardtii.
Proc Natl Acad Sci USA. 2016 Nov 1;113(44):12586-12591. doi: 10.1073/pnas.1606519113.




藻類のカルシウム結合タンパク質CASが重炭酸イオン輸送体の発現を調節することでCO2濃縮機構を制御していることを明らかにしました。また、CASが光とCO2の濃度変化によって葉緑体の中で局在を変化させるといった新しい現象も発見しました。 陸上植物のCASタンパク質は気孔の閉鎖を調節することで、CO2の取り込みを制御しています。つまり、藻類のCO2濃縮と陸上植物のCO2ガス交換といった、光合成維持のためのCO2の獲得システムが、CASという共通の因子で制御され、植物の進化の過程で保存されていることが分かってきました。
紹介記事
環境展望台
「京都大など、藻類のCO2濃縮機構の調節メカニズムを解明」
山野 隆志、福澤 秀哉
「微細藻の光合成を支える重炭酸イオン輸送 ー細胞膜と葉緑体包膜に局在する重炭酸イオン輸送体の発見ー」
化学と生物 54(7):459-460. (2016)
Yamano T, Fukuzawa H*
Indirect Immunofluorescence Assay in Chlamydomonas reinhardtii.
Bio-protocol: 6(13):e1864 (2016)


細胞内のタンパク質の局在を調べるときに使われる間接的免疫蛍光染色法の詳細なプロトコル。
Fukuzawa H, Yamano T, Ifuku K, Hayakawa Y
発明の名称「Method of transferring gene into algal cell involving utilizing multiple square-wave pulses in three steps」米国特許 番号9255276
2013年にJ Biosci Bioeng誌に報告した内容を含む形質転換技術の米国特許が成立しました。特許証はこちら。
2015年
Characterization of Cooperative Bicarbonate Uptake into Chloroplast Stroma in the Green Alga Chlamydomonas reinhardtii.
Proc. Natl. Acad. Sci. USA. 2015 Jun 9;112(23):7315-20. doi: 10.1073/pnas.1501659112.




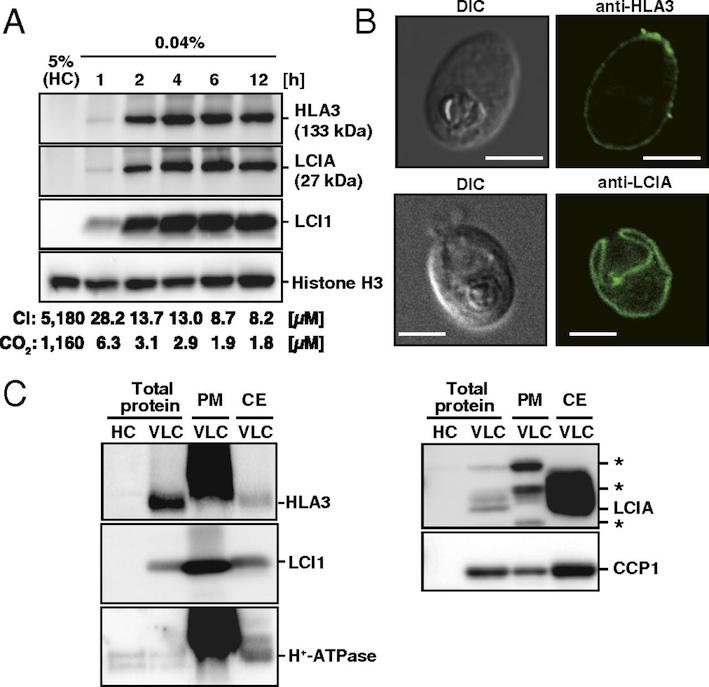
多くの藻類はCO2欠乏環境において、細胞外から細胞内に能動的に重炭酸イオンを取り込み、葉緑体内に濃縮することで光合成を維持することができます。この藻類のCO2濃縮現象は1980年に発見されましたが、その輸送を担っている分子の詳細は長らく不明でした。本論文は、細胞膜と葉緑体包膜の2段階からなる重炭酸イオン輸送経路(HLA3/LCIAシステム)を明らかにしました。
紹介記事
環境展望台
「京都大、藻類の光合成を支えるCO2濃縮システムを解明」
![]() Kajikawa M, Sawaragi Y, Shinkawa H, Yamano T, Ando A, Kato M, Hirono M, Sato N, Fukuzawa H*
Kajikawa M, Sawaragi Y, Shinkawa H, Yamano T, Ando A, Kato M, Hirono M, Sato N, Fukuzawa H*
Algal Dual-specificity Tyrosine-phosphorylation-regulated Kinase TAR1 Regulates Accumulation of Triacylglycerol in Nitrogen- or Sulfur-deficiency.
Plant Physiol. 2015 Jun;168(2):752-64. doi: 10.1104/pp.15.00319.


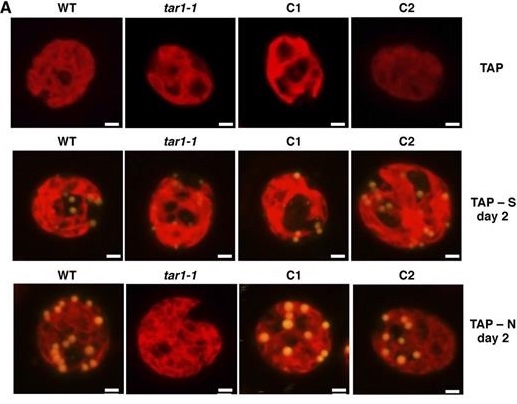
多くの藻類では硫黄や窒素欠乏条件下でトリアシルグリセロール(TAG)の蓄積が誘導されます。緑藻クラミドモナスのTAG蓄積異常変異体tar1-1の解析からその制御機構を担うリン酸化酵素遺伝子TAR1を同定しました。TAR1は硫黄と窒素欠乏に共通して培地中の酢酸を元にしたTAGの蓄積を正に制御し、窒素欠乏下の光合成活性の抑制にも関与することが分かってきました。
福澤 秀哉、山野 隆志、伊福 健太郎、早川 靖彦
発明の名称「3段階方式矩形波多重パルスを利用した藻類細胞への遺伝子導入法」国内特許 第5721191号
2013年にJ Biosci Bioeng誌に報告した内容を含む形質転換技術の国内特許が成立しました。特許証はこちら。

2014年
Wang L, Yamano T, Kajikawa M, Hirono M, Fukuzawa H*
Isolation and characterization of novel high-CO2 requiring mutants of Chlamydomonas reinhardtii.
Photosynth Res. 2014 Sep;121(2-3):175-84. doi: 10.1007/s11120-014-9983-x.



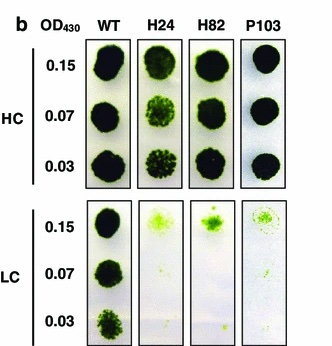
DNAタギングにより得られた約20,000株の形質転換株について、高CO2条件と低CO2条件での生育を比較し、LC条件でのみ生育が顕著に遅延する3株の高CO2要求性変異株を単離・解析しました。これらの変異株をさらに解析することで、クラミドモナスのCO2シグナル伝達の解明に向けて重要な知見を得ることができると考えています。
Yamano T, Asada A, Sato E, Fukuzawa H*
Isolation and characterization of mutants defective in the localization of LCIB, an essential factor for the carbon-concentrating mechanism in Chlamydomonas reinhardtii.
Photosynth Res 2014 Sep;121(2-3):193-200. doi: 10.1007/s11120-013-9963-6.



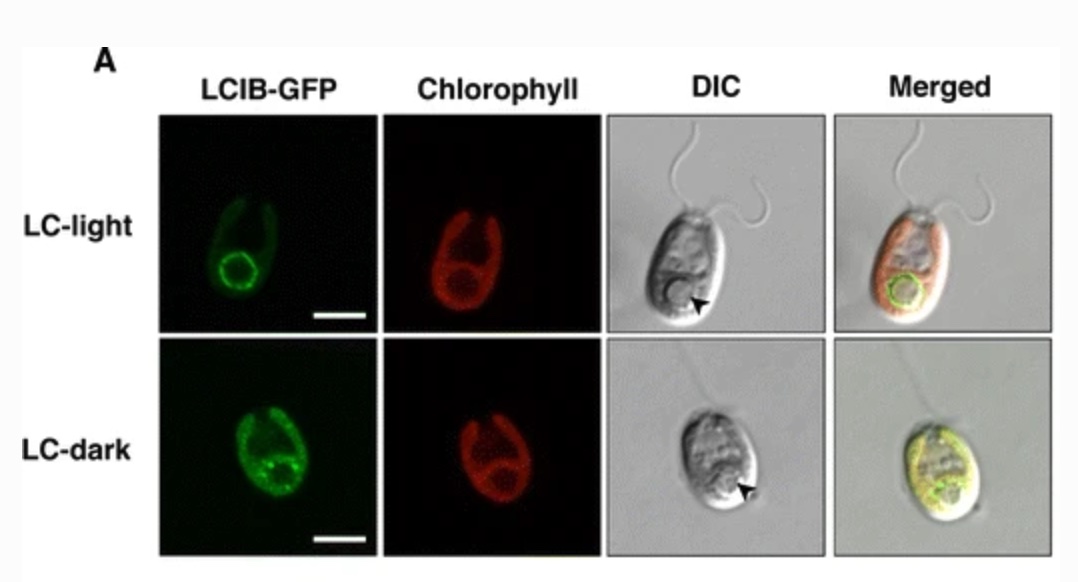
クラミドモナスのCO2濃縮に必須なLCIBタンパク質は、光の明暗とCO2濃度の変化によって葉緑体内で局在を変化させることが分かっています(Yamano et al. 2010 Plant Cell Physiol.)。 この論文ではその局在変化のメカニズムに迫る足がかりとして、DNAタギングにより得られた約13,000株の形質転換株について1株ずつLCIB局在の蛍光観察を行い、12株のLCIB局在異常変異株(aberrant LCIB localization, abl株)を単離・解析しました。 その中には、CO2濃縮において重要な炭酸固定の場であるピレノイドの細胞内での位置や数が異常になった変異株が多く含まれており、LCIBとピレノイドの密接な関係が明らかになってきました。
2013年
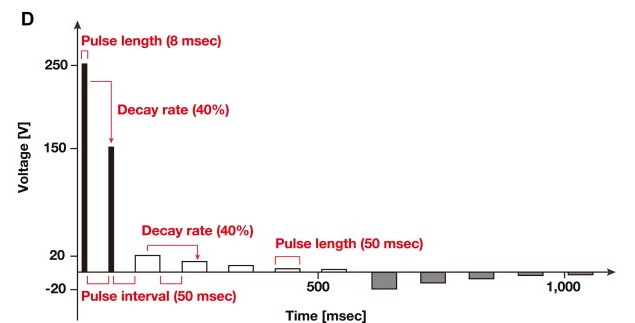
Rapid transformation of Chlamydomonas reinhardtii without cell-wall removal.
J Biosci Bioeng. 2013 Jun;115(6):691-4. doi: 10.1016/j.jbiosc.2012.12.020.



3段階方式矩形波多重パルスによるエレクトロポレーション法を利用した、迅速かつ高効率のクラミドモナス形質転換系を開発しました。従来の方法では、クラミドモナスの細胞壁を溶解させる必要があり、この溶解酵素の単離・溶解反応などのステップに多くの時間を要していました。 今回報告した方法では、細胞壁を溶解する必要はなく、細胞とDNAを直接混ぜた後にエレクトロポレーションによる形質転換が可能となりました。これによって、大規模な遺伝子破壊株ライブラリーの作成などが格段に容易になり、PCRスクリーニングによって調べたい遺伝子の変異株を単離することが可能となりました。 この技術は世界中のクラミドモナス研究者の中で広く使われています。